分子的立体构型
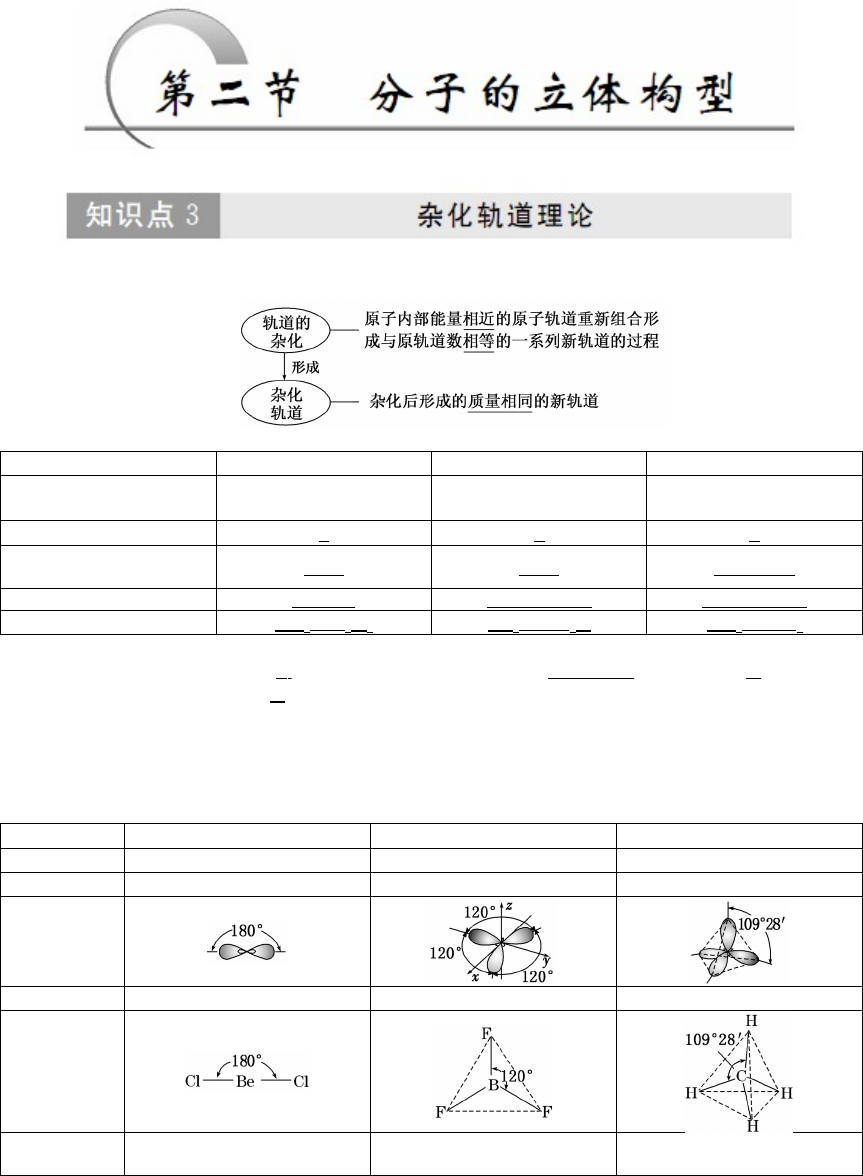
[新知探究]1.杂化与杂化轨道2.杂化轨道类型及分子立体构型杂化类型spsp2sp3参与杂化的原子轨道及数目1个s轨道和1个p轨道1个s轨道和2个p轨道1个s轨道和3个p轨道杂化轨道的数目__2____3____4__杂化轨道间的夹角__180
[新知探究]
1.杂化与杂化轨道
2.杂化轨道类型及分子立体构型
杂化类型 sp sp2sp3
参与杂化的原子轨道
及数目 1个s轨道和 1个p
轨道
1个s轨道和 2个p
轨道
1个s轨道和 3个p
轨道
杂化轨道的数目 __2__ __3__ __4__
杂化轨道
间的夹角 __180°__ __120°__ 109°28 ′
立体构型名称 直线形 平面三角形 正四面体形
实例 CO2、 C 2H2BF3、 CH 2O CH4、 CCl 4
3.杂化轨道与共价键类型
杂化轨道只能用于形成 σ
键。
[名师点拨]
分子的立体构型与杂化类型的关系
(1)当杂化轨道全部用于形成 σ键时
杂化类型 sp sp2sp3
轨道组成 一个 ns和一个 np一个 ns和两个 np一个 ns和三个 np
轨道夹角 180° 120° 109°28′
杂化轨道
示意图
实例 BeCl2BF3CH4
分子结构
示意图
分子的立
体构型 直线形 平面三角形 正四面体形
(2)当杂化轨道中有未参与成键的孤电子对时
由于孤电子对参与互相排斥,会使分子的构型与杂化轨道的形状有所区别。如水分子
中氧原子的 sp3杂化轨道有 2个是由孤电子对占据的,其分子不呈正四面体构型,而呈 V形,
氨分子中氮原子的 sp3杂化轨道有 1个由孤电子对占据,氨分子不呈正四面体构型,而呈三
角锥形。
[对点演练]
3.(2016·襄阳高二检测)下列关于杂化轨道的叙述中,不正确的是( )
A.杂化轨道可用于形成 σ键、π键或用于容纳未参与成键的孤电子对
免费试读已结束,如果需要继续阅读,请您下载
本文档需要3知币



